Audit Trail para garantizar la integridad de los datos en los procesos de fabricación farmacéutica
La firma electrónica biométrica dentro del registro de acciones del audit trail garantiza la integridad de los registros en entornos regulados GMP, ofreciendo un seguimiento detallado y confiable de las actividades registradas.
Como hemos evidenciado en artículos anteriores, asegurar la integridad de los datos es requisito obligatorio en entornos regulados GMP (Good Manufacturing Practices, NCF en español, Normas de Correcta Fabricación) como lo es la industria farmacéutica. Esto implica garantizar la identificación precisa de los empleados que llevan a cabo cada paso en los procesos de fabricación, entre otras responsabilidades.
Para asegurar la integridad de los datos en la industria farmacéutica, es fundamental seguir los principios esenciales conocidos como ALCOA+, tal como lo recomiendan organismos reguladores como la FDA (Administración de Alimentos y Medicamentos de EE. UU.) o la EMA (Agencia Europea de Medicamentos de la UE).
El acrónimo ALCOA+, creado por la FDA, se refiere a los criterios que los datos deben cumplir para ser precisos y confiables, asegurando que sean Atribuibles (identificando quién registró los datos y cuándo), Legibles (tanto en el presente como en el futuro), Contemporáneos (registrados en el momento en que se recopilan) y Originales, entre otros aspectos. En nuestro artículo La identificación de empleados en la industria farmacéutica según ALCOA+ podrás encontrar más información al respecto.
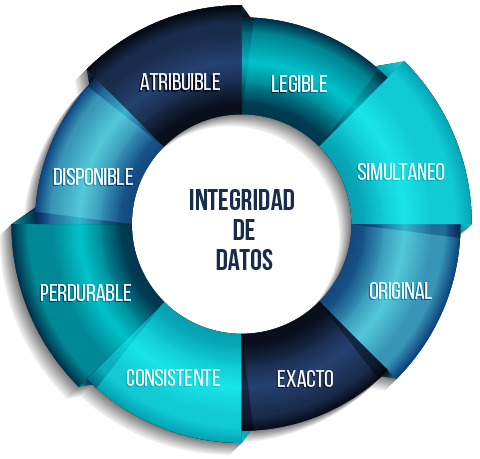
Para el caso que nos ocupa en el siguiente artículo, haremos especial énfasis en los requisitos de atribuibilidad y legibilidad de los datos registrados, ya que la regla ALCOA+ indica que el registro de la actividad debe atribuirse inequívocamente a la persona que la llevó a cabo, sin lugar a dudas, y que es imprescindible que los datos y metadatos en los registros de actividades reguladas sean claros y fáciles de entender. Además, indica que en los sistemas informáticos de registros, como un Audit Trail, se debe incluir información detallada sobre el usuario responsable, junto con otros datos relevantes.
¿Qué es un Audit Trail?
Los audit trails constituyen registros electrónicos seguros que permiten reconstruir eventos asociados con la creación, modificación o eliminación de registros electrónicos.
Estos registros ofrecen una documentación de apoyo y un historial para validar acciones operativas y de seguridad, o para detectar y contrarrestar desviaciones. En otras palabras, sirven como evidencia de conformidad e integridad operativa. Durante la validación del sistema informático, el audit trail se convierte en una herramienta esencial para preservar la información y la integridad del sistema.
Requisitos normativos del audit trail de un sistema informatizado
- Identificación del origen de los datos: Es necesario que en el registro de actividades reguladas se identifique claramente la persona, sistema o equipo que genera los datos. Para ello, se requiere que los administradores del sistema codifiquen adecuadamente a los usuarios y equipos asociados, garantizando una identificación única.
- Identificación de la actividad realizada: También es crucial que en el registro de las actividades reguladas se identifique la persona o sistema que lleva a cabo la actividad, ya sea generando o modificando datos.
- Registro completo de datos y metadatos: Es esencial que en el registro de actividades reguladas se incluyan todos los datos y metadatos relevantes.
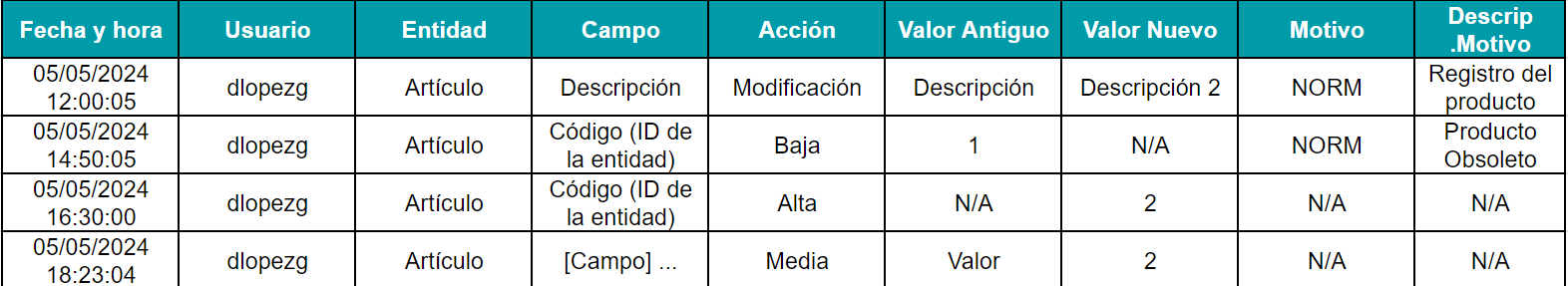
- Datos y metadatos asociados al audit trail: Esto incluye la fecha y hora de la actividad, el usuario responsable, la entidad afectada, el valor nuevo y antiguo (en caso de modificaciones), y el motivo del cambio.
- Disponibilidad de datos originales y modificaciones: Se debe garantizar que tanto los datos originales como cualquier modificación posterior y los resultados generados por el sistema estén disponibles para su revisión y seguimiento.
Características del sistema de audit trail
Las características esenciales del sistema de audit trail se diseñan para asegurar la integridad de los registros electrónicos. De acuerdo con regulaciones y estándares de las correctas prácticas, se requiere que el sistema de audit trail cumpla con los siguientes requisitos:
- Disponibilidad: Los audit trails deben estar siempre disponibles en un formato que permita su revisión por parte de los organismos reguladores.
- Automatización: Las entradas en el audit trail deben ser capturadas automáticamente por el sistema informático, sin intervención manual de los usuarios.
- Custodia: El audit trail debe conservarse durante el tiempo requerido para mantener la integridad de los registros electrónicos correspondientes.
- Rastreabilidad: Cada entrada en el audit trail debe ser atribuible a la persona responsable de ingresar los datos, y las actualizaciones no deben ocultar los valores anteriores. Además, se debe registrar la razón de cualquier cambio, cuando sea necesario según la regulación.
- Contemporaneidad: Cada entrada en el audit trail debe tener una marca de tiempo precisa y no modificable, utilizando un sistema de reloj controlado.
- Seguridad: Los datos del audit trail deben almacenarse de manera segura y ser inaccesibles para la edición por parte de cualquier usuario.
Ejemplo de audit trail de un sistema informatizado:
¿Cómo garantizar la integridad de los registros electrónicos?
La solución óptima pasa por la implementación de una firma electrónica biométrica para la identificación y registro de acciones dentro del audit trail; de esta forma se logra garantizar la integridad de los registros dentro de los entornos regulados GMP.
Este tipo de tecnología no solo brinda conveniencia a los usuarios al eliminar la necesidad de dispositivos extra o recordar contraseñas para su firma electrónica, sino que también asegura la rastreabilidad de las acciones y la integridad de los datos, cumpliendo plenamente con los requisitos regulatorios de la industria farmacéutica.
La tecnología biométrica aprovecha las características únicas de nuestro cuerpo para lograr una identificación precisa y cómoda para el empleado. Ejemplos de estas características incluyen las huellas dactilares, el rostro, la voz y los iris.
Te invitamos a leer artículos previos de nuestro blog donde hemos abordado más en este tema:
Averigua cómo con Verázial ID Pharma puede ayudarte a garantizar la integridad de los datos en los procesos de fabricación farmacéutica.
Contacta con nosotros para una demostración y/o estudio personalizado.
Referencias
- Trabajador irreconocible de cultivo con tableta [Freepik]
Audit Trail para garantizar la integridad de los datos en los procesos de fabricación farmacéutica
La firma electrónica biométrica dentro del registro de acciones del audit trail garantiza la integridad de los registros en entornos regulados GMP, ofreciendo un seguimiento detallado y confiable de las actividades registradas.
Como hemos evidenciado en artículos anteriores, asegurar la integridad de los datos es requisito obligatorio en entornos regulados GMP (Good Manufacturing Practices, NCF en español, Normas de Correcta Fabricación) como lo es la industria farmacéutica. Esto implica garantizar la identificación precisa de los empleados que llevan a cabo cada paso en los procesos de fabricación, entre otras responsabilidades.
Para asegurar la integridad de los datos en la industria farmacéutica, es fundamental seguir los principios esenciales conocidos como ALCOA+, tal como lo recomiendan organismos reguladores como la FDA (Administración de Alimentos y Medicamentos de EE. UU.) o la EMA (Agencia Europea de Medicamentos de la UE).
El acrónimo ALCOA+, creado por la FDA, se refiere a los criterios que los datos deben cumplir para ser precisos y confiables, asegurando que sean Atribuibles (identificando quién registró los datos y cuándo), Legibles (tanto en el presente como en el futuro), Contemporáneos (registrados en el momento en que se recopilan) y Originales, entre otros aspectos. En nuestro artículo La identificación de empleados en la industria farmacéutica según ALCOA+ podrás encontrar más información al respecto.

Para el caso que nos ocupa en el siguiente artículo, haremos especial énfasis en los requisitos de atribuibilidad y legibilidad de los datos registrados, ya que la regla ALCOA+ indica que el registro de la actividad debe atribuirse inequívocamente a la persona que la llevó a cabo, sin lugar a dudas, y que es imprescindible que los datos y metadatos en los registros de actividades reguladas sean claros y fáciles de entender. Además, indica que en los sistemas informáticos de registros, como un Audit Trail, se debe incluir información detallada sobre el usuario responsable, junto con otros datos relevantes.
¿Qué es un Audit Trail?
Los audit trails constituyen registros electrónicos seguros que permiten reconstruir eventos asociados con la creación, modificación o eliminación de registros electrónicos.
Estos registros ofrecen una documentación de apoyo y un historial para validar acciones operativas y de seguridad, o para detectar y contrarrestar desviaciones. En otras palabras, sirven como evidencia de conformidad e integridad operativa. Durante la validación del sistema informático, el audit trail se convierte en una herramienta esencial para preservar la información y la integridad del sistema.
Requisitos normativos del audit trail de un sistema informatizado
- Identificación del origen de los datos: Es necesario que en el registro de actividades reguladas se identifique claramente la persona, sistema o equipo que genera los datos. Para ello, se requiere que los administradores del sistema codifiquen adecuadamente a los usuarios y equipos asociados, garantizando una identificación única.
- Identificación de la actividad realizada: También es crucial que en el registro de las actividades reguladas se identifique la persona o sistema que lleva a cabo la actividad, ya sea generando o modificando datos.
- Registro completo de datos y metadatos: Es esencial que en el registro de actividades reguladas se incluyan todos los datos y metadatos relevantes.
- Datos y metadatos asociados al audit trail: Esto incluye la fecha y hora de la actividad, el usuario responsable, la entidad afectada, el valor nuevo y antiguo (en caso de modificaciones), y el motivo del cambio.
- Disponibilidad de datos originales y modificaciones: Se debe garantizar que tanto los datos originales como cualquier modificación posterior y los resultados generados por el sistema estén disponibles para su revisión y seguimiento.
Características del sistema de audit trail
Las características esenciales del sistema de audit trail se diseñan para asegurar la integridad de los registros electrónicos. De acuerdo con regulaciones y estándares de las correctas prácticas, se requiere que el sistema de audit trail cumpla con los siguientes requisitos:
- Disponibilidad: Los audit trails deben estar siempre disponibles en un formato que permita su revisión por parte de los organismos reguladores.
- Automatización: Las entradas en el audit trail deben ser capturadas automáticamente por el sistema informático, sin intervención manual de los usuarios.
- Custodia: El audit trail debe conservarse durante el tiempo requerido para mantener la integridad de los registros electrónicos correspondientes.
- Rastreabilidad: Cada entrada en el audit trail debe ser atribuible a la persona responsable de ingresar los datos, y las actualizaciones no deben ocultar los valores anteriores. Además, se debe registrar la razón de cualquier cambio, cuando sea necesario según la regulación.
- Contemporaneidad: Cada entrada en el audit trail debe tener una marca de tiempo precisa y no modificable, utilizando un sistema de reloj controlado.
- Seguridad: Los datos del audit trail deben almacenarse de manera segura y ser inaccesibles para la edición por parte de cualquier usuario.
Ejemplo de audit trail de un sistema informatizado:

¿Cómo garantizar la integridad de los registros electrónicos?
La solución óptima pasa por la implementación de una firma electrónica biométrica para la identificación y registro de acciones dentro del audit trail; de esta forma se logra garantizar la integridad de los registros dentro de los entornos regulados GMP.
Este tipo de tecnología no solo brinda conveniencia a los usuarios al eliminar la necesidad de dispositivos extra o recordar contraseñas para su firma electrónica, sino que también asegura la rastreabilidad de las acciones y la integridad de los datos, cumpliendo plenamente con los requisitos regulatorios de la industria farmacéutica.
La tecnología biométrica aprovecha las características únicas de nuestro cuerpo para lograr una identificación precisa y cómoda para el empleado. Ejemplos de estas características incluyen las huellas dactilares, el rostro, la voz y los iris.
Te invitamos a leer artículos previos de nuestro blog donde hemos abordado más en este tema:
Averigua cómo con Verázial ID Pharma puede ayudarte a garantizar la integridad de los datos en los procesos de fabricación farmacéutica.
Contacta con nosotros para una demostración y/o estudio personalizado.
Referencias
- Trabajador irreconocible de cultivo con tableta [Freepik]
Audit Trail para garantizar la integridad de los datos en los procesos de fabricación farmacéutica
La firma electrónica biométrica dentro del registro de acciones del audit trail garantiza la integridad de los registros en entornos regulados GMP, ofreciendo un seguimiento detallado y confiable de las actividades registradas.
Como hemos evidenciado en artículos anteriores, asegurar la integridad de los datos es requisito obligatorio en entornos regulados GMP (Good Manufacturing Practices, NCF en español, Normas de Correcta Fabricación) como lo es la industria farmacéutica. Esto implica garantizar la identificación precisa de los empleados que llevan a cabo cada paso en los procesos de fabricación, entre otras responsabilidades.
Para asegurar la integridad de los datos en la industria farmacéutica, es fundamental seguir los principios esenciales conocidos como ALCOA+, tal como lo recomiendan organismos reguladores como la FDA (Administración de Alimentos y Medicamentos de EE. UU.) o la EMA (Agencia Europea de Medicamentos de la UE).
El acrónimo ALCOA+, creado por la FDA, se refiere a los criterios que los datos deben cumplir para ser precisos y confiables, asegurando que sean Atribuibles (identificando quién registró los datos y cuándo), Legibles (tanto en el presente como en el futuro), Contemporáneos (registrados en el momento en que se recopilan) y Originales, entre otros aspectos. En nuestro artículo La identificación de empleados en la industria farmacéutica según ALCOA+ podrás encontrar más información al respecto.

Para el caso que nos ocupa en el siguiente artículo, haremos especial énfasis en los requisitos de atribuibilidad y legibilidad de los datos registrados, ya que la regla ALCOA+ indica que el registro de la actividad debe atribuirse inequívocamente a la persona que la llevó a cabo, sin lugar a dudas, y que es imprescindible que los datos y metadatos en los registros de actividades reguladas sean claros y fáciles de entender. Además, indica que en los sistemas informáticos de registros, como un Audit Trail, se debe incluir información detallada sobre el usuario responsable, junto con otros datos relevantes.
¿Qué es un Audit Trail?
Los audit trails constituyen registros electrónicos seguros que permiten reconstruir eventos asociados con la creación, modificación o eliminación de registros electrónicos.
Estos registros ofrecen una documentación de apoyo y un historial para validar acciones operativas y de seguridad, o para detectar y contrarrestar desviaciones. En otras palabras, sirven como evidencia de conformidad e integridad operativa. Durante la validación del sistema informático, el audit trail se convierte en una herramienta esencial para preservar la información y la integridad del sistema.
Requisitos normativos del audit trail de un sistema informatizado
- Identificación del origen de los datos: Es necesario que en el registro de actividades reguladas se identifique claramente la persona, sistema o equipo que genera los datos. Para ello, se requiere que los administradores del sistema codifiquen adecuadamente a los usuarios y equipos asociados, garantizando una identificación única.
- Identificación de la actividad realizada: También es crucial que en el registro de las actividades reguladas se identifique la persona o sistema que lleva a cabo la actividad, ya sea generando o modificando datos.
- Registro completo de datos y metadatos: Es esencial que en el registro de actividades reguladas se incluyan todos los datos y metadatos relevantes.
- Datos y metadatos asociados al audit trail: Esto incluye la fecha y hora de la actividad, el usuario responsable, la entidad afectada, el valor nuevo y antiguo (en caso de modificaciones), y el motivo del cambio.
- Disponibilidad de datos originales y modificaciones: Se debe garantizar que tanto los datos originales como cualquier modificación posterior y los resultados generados por el sistema estén disponibles para su revisión y seguimiento.
Características del sistema de audit trail
Las características esenciales del sistema de audit trail se diseñan para asegurar la integridad de los registros electrónicos. De acuerdo con regulaciones y estándares de las correctas prácticas, se requiere que el sistema de audit trail cumpla con los siguientes requisitos:
- Disponibilidad: Los audit trails deben estar siempre disponibles en un formato que permita su revisión por parte de los organismos reguladores.
- Automatización: Las entradas en el audit trail deben ser capturadas automáticamente por el sistema informático, sin intervención manual de los usuarios.
- Custodia: El audit trail debe conservarse durante el tiempo requerido para mantener la integridad de los registros electrónicos correspondientes.
- Rastreabilidad: Cada entrada en el audit trail debe ser atribuible a la persona responsable de ingresar los datos, y las actualizaciones no deben ocultar los valores anteriores. Además, se debe registrar la razón de cualquier cambio, cuando sea necesario según la regulación.
- Contemporaneidad: Cada entrada en el audit trail debe tener una marca de tiempo precisa y no modificable, utilizando un sistema de reloj controlado.
- Seguridad: Los datos del audit trail deben almacenarse de manera segura y ser inaccesibles para la edición por parte de cualquier usuario.
Ejemplo de audit trail de un sistema informatizado:

¿Cómo garantizar la integridad de los registros electrónicos?
La solución óptima pasa por la implementación de una firma electrónica biométrica para la identificación y registro de acciones dentro del audit trail; de esta forma se logra garantizar la integridad de los registros dentro de los entornos regulados GMP.
Este tipo de tecnología no solo brinda conveniencia a los usuarios al eliminar la necesidad de dispositivos extra o recordar contraseñas para su firma electrónica, sino que también asegura la rastreabilidad de las acciones y la integridad de los datos, cumpliendo plenamente con los requisitos regulatorios de la industria farmacéutica.
La tecnología biométrica aprovecha las características únicas de nuestro cuerpo para lograr una identificación precisa y cómoda para el empleado. Ejemplos de estas características incluyen las huellas dactilares, el rostro, la voz y los iris.
Te invitamos a leer artículos previos de nuestro blog donde hemos abordado más en este tema:
Averigua cómo con Verázial ID Pharma puede ayudarte a garantizar la integridad de los datos en los procesos de fabricación farmacéutica.
Contacta con nosotros para una demostración y/o estudio personalizado.
Referencias
- Trabajador irreconocible de cultivo con tableta [Freepik]
Suscríbete a nuestra newsletter
Recibe en tu correo información de interés sobre biometría para tu sector
También te puede interesar
También te puede interesar




